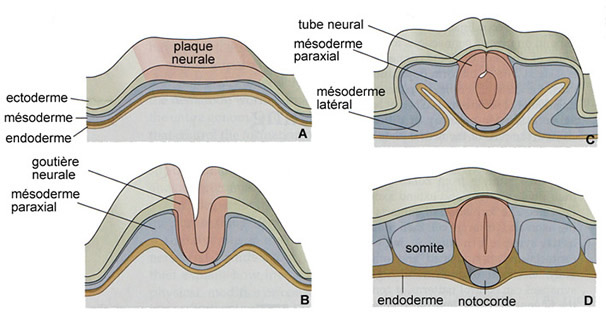
Les anomalies de fermeture du tube neural, spina bifida et anencéphalie, touchent chaque année en France, plus d’une grossesse sur 1000. Elles se constituent très tôt au cours de la grossesse, lors de la troisième et de la quatrième semaine post conceptionnelle et sont responsables de handicaps sévères.
Plusieurs études ont mis en évidence une relation entre la survenue de ce type de malformations et un déficit en acide folique (encore appelé vitamine B9 ou folates en raison de leur présence abondante dans les légumes verts « à feuilles ») en début de grossesse. Parallèlement, l’effet protecteur d’une supplémentation en acide folique des femmes avant même le début de la grossesse a été démontré même si la prévention n’est pas totale car des facteurs génétiques et environnementaux peuvent probablement intervenir dans la survenue de ce type de malformations.
Les résultats de ces études ont conduit certains pays où la survenue de ce type d’anomalies était plus fréquente qu’en France (pays anglo-saxons et Hongrie) à définir une politique de prévention dont l’objectif était d’augmenter les apports en acide folique chez les femmes avant le début de leur grossesse. Pour évaluer la nécessité éventuelle de renforcer la prévention, la Direction Générale de la Santé a réuni, à ce sujet, un groupe d’experts dont les conclusions la conduisent à rappeler les mesures de prévention existantes en direction des femmes en âge de procréer. La prévention s’appuie sur les professionnels de santé à qui il est demandé :
1. D’INSISTER AUPRÈS DES FEMMES EN AGE DE PROCRÉER sur la nécessité de consommer des aliments riches en folates : légumes verts à feuilles, légumes secs, agrumes … A cette fin, elles pourront s’appuyer sur la brochure d’information intitulée « BIEN SE NOURRIR AU FÉMININ », réalisée à cet effet par le Ministère de l’Emploi et de la Solidarité et le Ministère de l’Agriculture et de la Pêche. Cette brochure a été largement diffusée en janvier 2000 aux médecins généralistes, gynécologues, obstétriciens, professionnels des services de PMI et enseignants en biologie des lycées. Elle est disponible auprès du Comité français d’éducation de la santé (CFES) et de ses réseaux locaux (CDES).
2. DE RÉALISER POUR LES FEMMES A RISQUE ÉLEVÉ une supplémentation en acide folique à la dose de 5 mg/jour, dès qu’elles envisagent une grossesse (une spécialité pharmaceutique est disponible). Il est rappelé que les femmes à risque élevé sont d’une part celles qui ont un antécédent de grossesse avec anomalie de fermeture du tube neural et, d’autre part, celles qui sont traitées par certains médicaments anti-épileptiques (du fait des carences en folates qu’ils peuvent induire).
3. POUR LES FEMMES SANS ANTÉCÉDENT PARTICULIER ET QUI DESIRENT CONCEVOIR, une supplémentation systématique est préconisée mais à une dose moindre de 0.4 mg/jour. Plusieurs spécialités pharmaceutiques comportent de l’acide folique à ce dosage, mais en association avec d’autres principes actifs qui empêchent leur administration prolongée et leur administration au cours de la grossesse. C’est la raison pour laquelle la Direction Générale de la Santé a effectué les démarches nécessaires afin qu’une spécialité pharmaceutique d’acide folique, en principe unique et dosée à 0.4 mg, soit au plus tôt disponible sur le marché. En attendant l’existence d’un complément alimentaire contenant uniquement de l’acide folique dosé à 0.2 mg/comprimé est signalée (acide folique CCD).
La Direction Générale de la Santé (DGS) rappelle que, pour être efficace, cette prévention doit être entreprise 4 semaines avant la conception et se poursuivre 8 semaines après celle-ci.
Des actions de sensibilisation en direction du grand public relaieront ces messages, dans le cadre du programme national nutrition santé actuellement en préparation.
Ministère des Affaires Sociales, communication du 31/08/2000.
Le groupe de travail réuni par la Direction Générale de la Santé était constitué de Mesdames les Docteurs : S. DEHE, E. ELEFANT, J. GOUJARD, de Maame G. POTIER de COURCY et de Messieurs les Professeurs : G.L BOOG, J. HOROVITZ, de Monsieur le Docteur P. MASNOU et de Monsieur le Professeur H.J. PHILIPPE.
Causes des AFTN
Le caractère génétique de la survenue des AFTN est affirmé sur un faisceau d’arguments: le principal étant la fréquence des récurrences de SB, de dix fois supérieure à celle des cas princeps; le risque relatif est également plus important chez les gens d’une même famille (Czeizel 1995, Aubard 1997).
Cependant 95% des cas sont des cas sporadiques, survenant chez des femmes sans antécédent.
Les études épidémiologiques ont montré que les variations de la prévalence des SB sont très largement expliquées par celles du statut en folates (Daly 1995, Wald 1998) (tableau I).
Cette influence du statut en folates sur le risque d’AFTN est unanimement confirmé par les études de prévention secondaire et primaire; au cours de ces essais l’effet d’une supplémentation par des folates seuls ou associés à d’autres vitamines a été comparé à un placebo ou à une association d’oligo-éléments; les sujets avaient déjà eu une grossesse marquée par une AFTN (prévention secondaire) ou tentaient de prévenir la survenue d’un premier cas d’AFTN (prévention primaire).
Les études rapportées montrent qu’une supplémentation quotidienne de 0,4-4mg folates, commencée 1 mois avant la grossesse et poursuivie durant ses deux ou trois premiers mois prévient la récidive des AFTN dans 50-70% des cas; peu d’études ont utilisé une supplémentation isolée en folates; l’association d’autres vitamines aux folates ne semble pas apporter une plus grande efficacité à la supplémentation, suggérant que ceux ci sont bien l’élément actif (Bower 1989, Kirke 1992, Laurence 1981, Mills 1989, Milunsky 1989, MRC Vitamin Study Research Group 1991, Mulinare 1988, Nevin 1990, Shaw 1995, Smithells 1989, Vergel 1990, Wald 1993, Werler 1993) et la survenue de cas princeps dans une population sans antécédents (Czeizel 1992).
Mécanismes d’action de la supplémentation en folates
Plusieurs études ont montré des taux de folates en moyenne plus bas chez les mères ayant donné naissance à un enfant atteint d’AFTN, comparés aux témoins (Smithells 1976, Kirke 1993, Daly 1995, Mills 1995); cependant toutes les études ne retrouvent pas cette association (Wald 1993). De plus la vitamine B12 peut aussi être abaissée, alors que l’homocystéinémie est élevée (Mills 1995).
Bien que la notion de dose seuil au delà de laquelle les folates exerceraient un effet protecteur (Daly 1997) soit contestée (Wald 1998), le risque est surtout diminué lorsque les folates érythrocytaires s’approchent de la normalité (> 300-400ug/L)(Czeizel 1995).
Ces observations suggèrent:
– le rôle favorisant de la carence en folates dans la genèse des AFTN
– l’association possible d’un défaut d’apport avec d’autres causes favorisantes, en particulier métaboliques, augmentant les besoins en folates; il serait alors nécessaire que certaines femmes aient des apports en folates élevés pour pallier une carence fonctionnelle.
Le rôle des folates dans l’hématopoïèse et la prolifération cellulaire est connu. Leur carence empêche la division cellulaire et la synthèse protéique; elle est responsable d’une anémie macrocytaire qui ne doit pas être confondue avec l’anémie due à la carence en vitamine B12 dont le risque est très faible chez la femme jeune dans les pays occidentaux.
Le rôle biologique des folates, sous leur forme réduite (tétrahydro-), est de transporter les groupes méthyles. Ainsi ils sont impliqués dans deux métabolismes fondamentaux :
1. ils sont les cofacteurs d’enzymes de la synthèse de novo des bases puriques et pyrimidiques formant l’ADN ; ils fournissent des unités monocarbonées à partir du pool de tétrahydrofolates.
2. les folates servent de donneur de méthyle pour régénérer la méthionine à partir de l’homocystéine, par l’action de la méthionine synthétase qui a pour coenzyme le méthyl THF et la vitamine B12 (figure 1).
La méthionine est activée en S-adénosylméthionéine utilisée comme donneur de méthyl dans toutes les réactions de méthylation, servant en particulier à la synthèse de la myéline et donc à la maturation du système nerveux; elle participe à la synthèse de nombreux neurotransmetteurs.
La vitamine B 12 est impliquée dans la régénération de la méthionine; un défaut d’apport peut être un facteur limitant dans le cycle des radicaux monocarbonés.
Les travaux récents sur la génétique de la tetra hydrométhyl folate réductase (MTHFR) ont apporté des éléments nouveaux sur la génétique des AFTN, le mécanisme de protection des folates et l’implication d’autres composants vitaminiques: la MTHFR est l’enzyme nécessaire à la production de THF et donc impliquée dans la reméthylation de la méthionine a comme cofacteur la vitamine B12; les mères de nouveau-nés atteints d’AFTN ont à la fois des taux de vitamine B12 abaissés et une hyperhomocystéinémie (Mills 1995); les femmes présentant à l’état homozygote une mutation de la MTHFR ont des besoins de folates élevés pour maintenir des taux d’homocystéine normaux (Steegers-Theunissen 1994). La prévalence de défauts sur le gène de la MTHFR pourrait rendre compte d’un cinquième des AFTN liées aux folates (Whitehead 1995, van der Put 1996, Ou 1996, Kirke 1996). La mutation du gène de la MTHFR est associée à une augmentation 3 à 7 fois du risque d’AFTN chez les femmes homozygotes (Whitehead 1995, van der Put 1996, Ou 1996, Kirke 1996).
Cependant, l’étude des relations entre les apports de folates et la présence de la mutation de la MTHFR a confirmé que les femmes homozygotes pour la mutation du gène ont bien un risque 1,6 à 2 fois plus élevé que celles ne portant pas cet allèle, mais l’effet des variations d’apport de folates est limité: chez les femmes n’ayant pas pris de supplémentation vitaminique pendant la grossesse, le risque est le plus élevé pour le quartile d’apports le plus faible (5,2 par rapport aux contrôles) et le plus faible (1,7) pour le quartile le plus élevé; la supplémentation périconceptionnelle réduit le risque à 1,2, dans cette étude impliquant 162 femmes (Shaw 1998).
Il n’est pas certain que l’homocystéinejoue un rôle dans la genèse des AFTN; il semble plus qu’elle soit un marqueur du défaut de reméthylation de la méthionine dont la production insuffisante à un stade critique du développement serait à l’origine des malformations. Que l’anomalie métabolique responsable touche la méthionine synthétase ou la MTHFR, la supplémentation par l’acide folique faciliterait la reméthylation de la méthionine. A l’appui de cette hypothèse, les études récentes montrent que la supplémentation par l’acide folique corrige l’hyperhomocystéinémie (Boushey 1995, Guttormsen 1996, Malinow 1998), mais que cet effet n’est pas parallèle à l’augmentation des taux de folates (Malinow 1998).
Les recommandations de supplémentation en folates semblent donc satisfaire l’augmentation éventuelle des besoins liée au trouble métabolique de la reméthylation de la méthionine; certains préconise cependant qu’une supplémentation de Vitamine B12 soit associée à celle de folates en prévention des AFTN (Mills 1995, Oakney 1997).
Autres facteurs exogènes possibles
Les différents essais d’intervention nutritionnelle montrent que la supplémentation par les folates aux doses de 300-800ug ne prévient pas complètement la survenue d’AFTN; le problème de l’apport de vitamine B12 nécessaire pour pallier un trouble du métabolisme a été évoqué précédemment. D’autres facteurs peuvent être suspectés: la carence expérimentale en zinc est tératogène; cependant les études d’intervention ne suggèrent pas que le zinc joue un rôle dans la genèse ou la prévention des AFTN chez l’homme; chez la souris, la carence en myo-inositol est également responsable expérimentalement d’AFTN, alors que la supplémentation par l’inositol peut prévenir certaines AFTN résistantes à l’acide folique (Greene 1997).
Différentes pathologies ou prises médicamenteuses favorisent la carence en folates, par défaut d’apport et perturbation de leur métabolisme: un pour cent des foetus exposés à l’acide valproïque présente une AFTN (Aubard 1997). Les anticonvulsivants (diphényihydantoïne, primidone, phénobarbital) entraînent une anémie mégaloblastique chez moins d’un pour cent des sujets traités.
Dans 20-50% des cas l’alcoolisme chronique est responsable d’un tableau biologique de carence en folates, du à une carence d’apports associée à une perturbation de leur métabolisme. Cependant l’influence de l’alcoolisme foetal sur la survenue d’AFTN est mal apprécié (Aubard 1997).
La vitamine C a été trouvée abaissée chez les femmes d’enfant porteur d’une AFTN (Smithells 1976).
En fait les carences nutritionnelles sont souvent associées entre elles et aux conditions pathologiques et socio-économiques défavorables; les causes évoquées ne sont donc pas incompatibles, au contraire, avec une carence en folates.
Ces circonstances représentent des facteurs de risque dont les relations avec la survenue d’AFTN sont mal précisées.
Métabolisme des folates alimentaires
Les polyglutamates constituent 90% des folates de l’alimentation.
Ils sont absorbés sous forme de monoglutamates après leur transformation par les déconjugases de la bordure en brosse. Dans les entérocytes une partie des folates absorbés est méthylée et réduite en méthyl-tétrahydrofolates (CH3-THF).
Dans le foie les folates sont transformés en CH3-THF et stockés sous forme de polyglutamates.
Les réserves hépatiques de 5-lOmg couvrent les besoins pour une durée d’environ 4 mois.
Sources: les principales sources sont les légumes à feuilles (épinards, salades), qui représentent à eux seuls la moitié des apports, et le foie. Le pain, les céréales et les pommes de terre représentent environ 19% des apports, la viande, le poisson et les œufs 14%, les produits laitiers 11%.
L’acide folique est sensible à la lumière, aux variations de pH, aux agents oxydants et réducteurs ; une partie est perdue dans les eaux de cuisson comme pour toutes les vitamines hydrosolubles. Les aliments consommés peuvent avoir perdu 50% de leur contenu initial.
De Plus l’absorption digestive des folates alimentaires, proche de 50%, est plus faible que celle de l’acide folique synthétique apporté sous forme de supplément médicamenteux qui est absorbé à 100% à jeun et à 85% environ quand il est consommé avec des aliments. Le terme d’équivalent des folates alimentaires (Dietary Folate Equivalent: DFE) a donc été créé pour l’interprétation des études dans lesquelles les folates étaient apportés sous forme alimentaire et de suppléments. Ceci revient en fait à doubler l’efficacité des suppléments par rapport aux apports alimentaires.
Ces données sont à prendre en compte pour l’interprétation des enquêtes de consommation et prévoir l’efficacité des recommandations diététiques éventuelles, d’autant que la consommation de légumes est faible dans les populations exposées à la carence en folates du fait de leurs conditions socio-économiques (Baudier 1997).
Il faut dissocier les apports nutritionnels recommandés pour satisfaire les besoins de l’organisme y compris pendant les périodes de forte activité de division cellulaire comme la grossesse, de ceux nécessaires à l’obtention d’un effet sur la santé, donc pharmacologique.
Conclusions
Si le mode d’action des folates est encore mal connu, leur effet préventif sur la survenue sporadique et la récidive d’AFTN est prouvé par les méta-analyses (banque de données COCHRANE).
Seule la consommation d’aliments enrichis ou de formes médicamenteuse apportant au moins 400 ug/j de folates s’est avérée efficace; la supplémentation doit précéder d’au moins un mois la conception en raison du délai nécessaire à la modification des réserves cellulaires et de la précocité de la constitution des AFTN (< 1er mois de grossesse).
A cette dose la supplémentation ne semble pas susceptible d’entraîner d’effets secondaires. Dans cette indication elle ne nécessite pas d’être associée à d’autres vitamines.
Sa prescription devrait donc être proposée non seulement en prévention d’une récidive d’AFTN, mais de façon systématique avant toute grossesse, en particulier s’il existe un risque de carence.
Références
Aubard Y, Piver P, Chinchilla AM, Baudet JH. Folates et tube neural- Revue de la littérature. J Gynécol Obstet Biol Reprod 1997 ; 26: 576-584.
Bairati I, Herbeth B, Spyckerelle Y et coll. Dietary intake and other déterminants of iron and folate status in female adolescents. J Clin Biochem Nutr 1989 ; 7: 143-151.
Baudier F, Rotily M, Le Bihan G, Janvrin MP, Mochaud C. Baromètre santé nutrition 1996. Editions CFES, Vanves 1997.